


Dieter Hassler
Wir müssen weit zurück in die Vergangenheit, um die Anfänge der Ehrlichiose-Forschung zu finden. In den neunziger Jahren des neunzehnten Jahrhunderts grassierte eine Erkrankung in afrikanischen Kuh-, Schaf- und Ziegenherden, die unter dem Namen "Heartwater" bekannt wurde. Bei dieser Krankheit kam es zur Ausbildung eines ausgeprägten Pericardergusses. Die Infektion hatte infolge kapillärer Blutungen im Gehirn oft letale Folgen.
In den Folgejahren wurden zeckenverseuchte afrikanische Rinder in die Karibik exportiert, wo es ebenfalls zu Ausbrüchen kam. Man befürchtete ein Übergreifen auf das nordamerikanische Festland. Daher war bereits damals das Interesse der amerikanischen Forscher an dieser Erkrankung groß.
1899 begann man mit Versuchen, die Krankheit auf zuvor gesunde Tiere zu übertragen, um deren infektiöse Natur zu untermauern. Zum Glück für die beteiligten Forscher erübrigten sich hier die sonst so beliebten Selbstversuche. Die Übertragung gelang.
Im Jahre 1910 wurde mittels neuentwickelter Färbetechniken in Blutausstrichen ein verwandter Erreger sichtbar gemacht, der als Anaplasma marginale bezeichnet wurde (Theiler 1910). 1925 erkannte Cowdry den nach ihm benannten Erreger Cowdria ruminatium als Erreger der Heartwater-Erkrankung bei Kühen, Schafen und Ziegen, Donatien beschrieb 1935 den heute als Ehrlichia canis bekannten Vertreter, Gordon entdeckte E. phagocytophila 1940.
Interessanterweise wurde in der Veterinärmedizin über Jahrzehnte den Ehrlichien Aufmerksamkeit geschenkt (Gribble 1969), während die Humanmediziner sich in dem Glauben sonnten, von dieser Gattung verschont zu bleiben. Erst in den fünfziger Jahren unseres Jahrhunderts lernte man, intrazellulär lebende Bakterien und Viren unter anderem dadurch zu unterscheiden, daß letztere nicht gegen Antibiotika empfindlich waren. Nun erkannte man, daß die Tetracycline gegen Ehrlichien und ähnliche Erreger (wie etwa Rickettsien) wirkten.
In Japan kam es 1965 zur Entdeckung von Ehrlichia sennetsu, die beim Genuß von rohem Fisch, wie dies in Japan sehr beliebt ist, übertragen wird. Sie war die erste entdeckte humanpathogene Art und löst ein Krankheitsbild aus, das man als Mononucleose-ähnlich beschrieb.Auch in den folgenden Jahren wurden zahlreiche neue Arten entdeckt (E. equi 1969, E. ewingii 1971 und E. risticii 1984). Eine besondere Berühmtheit erlangte E. canis, weil diesem Erreger hunderte von militärisch eingesetzten Hunden während des Vietnamkrieges zum Opfer fielen, bis man die Ursache erkannte und die Epidemie durch Zeckenbekämpfung und frühzeitige antibiotische Therapie der erkrankten Hunde beherrschen lernte (Davidson 1978).
Betrachtet man die verschiedenen bisher bekannten Ehrlichien, so fällt eine völlige Trennung ihrer bevorzugten Lebensräume auf. Einige Arten bevorzugen offensichtlich den aquatischen, andere leben terrestrisch ohne erkennbare Bindung zum Wasser. Zu ersteren gehört E. sennetsu, die natürlicherweise in Fischparasiten vorkommt und deshalb, wie oben erwähnt, durch den Genuß rohen Fisches übertragen wird. Eine Infektion kann also über den Magendarmtrakt erfolgen.
Ähnliches kennt man aus der Veterinärmedizin. In Alaska und Kanada wurden immer wieder scheinbare Fischvergiftungen bei Säugetieren wie Koyote, Hund und Schwarzbär beobachtet. Zunächst interpretierte man die sogenannte "Salmon poisoning disease" als Ergebnis von bakteriellen Verwesungsvorgängen mit Toxinbildung. Inzwischen weiß man, daß es sich mitnichten um die Folgen verdorbener Fische handelte, sondern um eine Ehrlichieninfektion. Die fischfressenden Tiere infizieren sich auf dem Weg der Nahrungsaufnahme mit Neorickettsia helminthocea, die wie E. sennetsu über parasitische Helminthen die Fische infiziert. Es konnte gezeigt werden, daß nicht etwa der Wurm, sondern tatsächlich die Ehrlichieninfektion für die Erkrankung der Koyoten verantwortlich war Foreyt 1987).
Theoretisch sollte eine derartige Übertragung auch auf den Menschen möglich sein. Wahrscheinlich hat nur die Tatsache, daß Amerikaner und Europäer ihren Lachs lieber gebraten essen, Erkrankungen verhindert. Das Lachscarpaccio der "neuen Küche" sollte man vielleicht doch eher überdenken.
Auch um Ehrlichia risticii rankt sich eine spannende Geschichte. 1979 trat bei Pferden in der Umgebung des Potomac-River in Maryland eine schwere Erkrankung auf, die im Anschluß auch in anderen Staaten (nach Palmer 1993 auch in Europa!) gefunden wurde. Die Pferde litten an Fieber, Anorexie und Durchfällen. Bei nicht rechtzeitiger Rehydratation und antibiotischer Behandlung verlief die Krankheit in vielen Fällen letal. Da unter anderem teure Rennpferde betroffen waren, war das Interesse an der Klärung dieser Krankheitsfälle erheblich. Nicht viel später wurde E. risticii als auslösendes Agens erkannt. Derselbe Errreger wurde später auch bei erkrankten Hunden entdeckt (Kakoma 1994).Völlig unklar blieb zunächst, wie der Erreger zu den Pferden bzw. den Hunden kam. Man suchte ihn in allen denkbaren Vektoren, unter anderem in Zecken, ohne jemals eine Spur von ihm entdecken zu können. Allein der Fluß schien eine Rolle zu spielen, waren doch viele der infizierten Pferde hier zur Tränke geführt worden. Noch Anfang des Jahres 1998 war das Problem ungelöst. In einer Arbeit von Februar dieses Jahres wird unter "Übertragungsweg" schlicht notiert: unbekannt. Wenige Monate später hatte diese Frage eine überraschende Antwort gefunden.
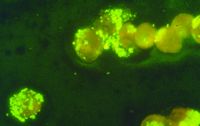
Jeffrey Barlough (1998) und Mitarbeiter hatten Wasserschnecken der Gattung Juga gesammelt und diese in Aquarien gesetzt. Nach einer gewissen Zeit sonderten die Schnecken große Mengen von Zerkarien ab. Dies sind Zwischenstadien von Trichobilharzia und verwandten Arten, die sich in diesen Wasserschnecken entwickeln. Normalerweise verläuft der Entwicklungszyklus so, daß die Zerkarien Wasservögel, vor allem Entenarten, infizieren und sich in diesen weiterentwickeln. Nach der Ausscheidung von Eiern mit den Fäkalien der Enten kehrt Trichobilharzia als Miracidium zu den Wasserschnecken zurück und der Zyklus beginnt von neuem.
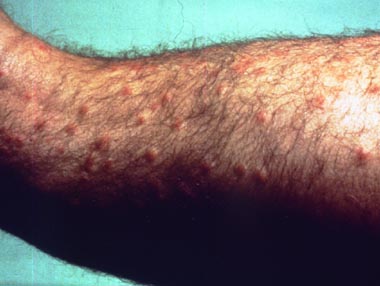
Gelegentlich "verirren" sich die Zerkarien und attackieren ungeeignete Wirte. Mancher Badegast kann ein Lied von dieser Plage singen, wenn ihn nach dem Besuch eines Baggersees oder Teichs hunderte dieser Zerkarien attackiert haben und seine Hautoberfläche von zahlreichen juckenden Läsionen übersät ist.
Ähnliche Zerkarien, so fanden Barlough und Mitarbeiter heraus, übertragen (zumindest in Amerika) E. risticii auf Pferde, die mit dem Wasser Kontakt haben, wobei allerdings noch nicht ganz klar ist, ob es eine aktive Übertragung gibt oder auch diese Ehrlichiose oral, also beim Trinken zerkarienhaltigen Wassers, übertragen wird. Trotzdem, Zerkarien sind wahrlich ein ungewöhnlicher Vektor! Es bleibt die Frage, ob auf diese Weise vielleicht auch Menschen mit E. risticii infiziert werden können. Doch diese Frage ist noch völlig ungelöst. Einiges spricht dafür, daß die aquatisch lebenden Ehrlichien eine eigene Gruppe innerhalb der Gattung bilden und nahe verwandt sind. Sie sind aber von aquatisch lebenden Rickettsien (siehe dort) klar zu trennen.
Eine ganz andere Ökologie finden wir bei den übrigen Ehrlichien. Sie sind in der Regel an Zecken als Vektoren gebunden. Reservoire sind verschiedene Säuger, unter anderem Weißwedelhirsche.
Tabelle: ausgewählte Ehrlichien und assoziierte Krankheitsbilder
| terrestrische Ehrlichien | Vektor | infiziert werden u.a. | Zellaffinität |
|---|---|---|---|
| HGE-Agent | Ixodes-Zecken | Menschen | Granulozyten |
| E. phagozytophila | Ixodes-Zecken | Huftiere | Granulozyten |
| E. equi | Ixodes-Zecken | Pferde, Menschen | Granulozyten |
| E. chaffeensis | Amblyomma-Zecken | Menschen, Hirsche | Monozyten |
| E. canis | Haemaphysalis und Riphicephalus- Zecken | Hunde | Granulozyten |
| E. ewingii | Zecken | Kaninchen | Granulozyten |
| E. platys | Zecken | Hunde | Thrombozyten |
| aquatische Ehrlichien | |||
| E. sennetsu | Trematoden in rohem Fisch (oral) | Menschen | Monozyten |
| E. risticii | Zerkarien (aktiv oder oral?) | Pferde, Hunde | Monozyten |
| NeoRickettsia helminthocea | Helminthen in rohem Fisch (oral) | Hunde, Bären, |
Ehrlichien sind kleine, obligat intrazellulär lebende, gramnegative Bakterien. Die verschiedenen Arten haben im Laufe der Evolution eine spezifische Zellaffinität entwickelt. Einige leben ausschließlich in Granulozyten, andere nur in Monozyten. Eine Art, die allerdings (soweit wir wissen) beim Menschen nicht vorkommt, lebt in Thrombozyten.
Die HGE wird von einer noch unbenannten Ehrlichienart verursacht, die nahe mit E. phagozytophila und E. equi verwandt ist. Vektoren sind nach derzeitiger Kenntnis vor allem Ixodes-Zecken , die auch Hauptüberträger der Borreliose sind. Die Zecken bleiben, wenn sie den Erreger bei einer Blutmahlzeit an einem bakteriämischen Wirt aufgenommen haben, transstadiell infiziert und geben die Ehrlichien bei der nächsten Blutmahlzeit weiter, weil diese in den Speicheldrüsen der Zecken persistieren. Reservoire sind unter anderem Schafe, Weißwedelhirsche (Odocileus virginianus, das amerikanische Äquivalent unserer Rehe), aber auch Mäusearten wie Peromyscus leucopus (Weißfuß-Hirschmaus) und Wühlmäuse (Walker 1997).
Akute Erkrankungen wurden fast ausschließlich in den Sommermonaten beobachtet.
Fieber 100%
Myalgien 98%
Rigor 95%
Gewichtsabnahme 37%
Schwindel 39%
Erbrechen 34%
Lymphknotenschwellungen 2%
Durchfälle 10%
Leibschmerzen 8%
Verwirrtheit 17%
Exanthem 2%
Leukopenie 50%
Thrombopenie 92%
Transaminasenerhöhung 91%
53% der bisher bekannten Patienten wurden hospitalisiert, 5% starben.
Nicht immer verläuft die HGE spontan limitiert. Schwere Komplikationen inklusive letaler Verläufe wurden wie bei der HME bekannt. Neben neurologischen Komplikationen bis hin zur Meningitis in der Akutphase konnten auch Panzytopenien durch Befall der Vorläuferzellen im Knochenmark beobachtet werden (Klein 1997).
Da die Erkrankung chronisch verlaufen kann, sind rekurrierende Fieberschübe mit schweren Allgemeinsymptomen gelegentlich zu beobachten. Bei einem eigenen Fall konnten wir nachvollziehen, daß sich der Betroffene 1990 in Kansas/USA nach multiplen Zeckenstichen infiziert hatte. Über acht Jahre traten die Fieberschübe zunächst etwa in vierzehntägigem Abstand, später etwa alle zwei Monate auf. Immer wieder wurden umfangreiche serologische und klinische Untersuchungen veranlaßt, die keinerlei tragfähige Diagnose erbrachten. Erst im August 1998 konnte durch Nachweis spezifischer Antikörper und Bestätigung mit dem Westernblot die Ätiologie geklärt werden. Nach dreißigtägiger Doxycyclintherapie wurde der Patient erstmals seit Jahren wieder beschwerdefrei.
Der Erreger der HME, Ehrlichia chaffeensis, wurde erstmals aus dem Blut eines erkrankten Patienten isoliert. Später wurde er in Amblyomma -Zecken und Weißwedelhirschen aus vielen Gegenden der USA gefunden (Lockhart 1997). Beide scheinen für die Verbreitung der HME eine entscheidende Rolle zu spielen, da die Weißwedelhirsche nach Infektion an einer langdauernden Bakteriämie leiden. Deshalb können Zecken im Larven- oder Nymphenstadium den Erreger problemlos aufnehmen und bei ihrer nächsten Blutmahlzeit weitergeben. Während bei der Borreliose Mäuse das eigentliche Reservoir darstellen und Rehe und Hirsche lediglich als Transportmittel borrelienhaltiger Zecken dienen, haben sie für die Ehrlichiose den Charakter eines echten Reservoirs.
Die HME imponiert als systemische Erkrankung mit gewissen Ähnlichkeiten zum Rocky-Montain-spotted-fever. Die meisten Symptome sind eher unspezifisch (siehe Tabelle). In der von Fishbein (1994) vorgestellten Referenz-Serie der CDC scheinen schwere Verläufe deutlich überrepräsentiert, da in einer prospektiven Untersuchung an US-Soldaten gefunden wurde, daß 67% der Erkrankungen als asymptomatische Serokonversionen ablaufen. Walker (1997) diskutiert, daß es sich durchaus um unterschiedliche Ehrlichienspecies gehandelt haben könne, da die derzeit eingesetzten serologischen Testverfahren erhebliche Kreuzreaktionen zeigen.
Fieber 97%
Kopfschmerzen 81%
Myalgien 68%
Gewichtsabnahme 66%
Schwindel 48%
Lymphknotenschwellungen 25%
Durchfälle 25%
Leibschmerzen 22%
Verwirrtheit 20%
Exanthem 36%
Leukopenie 60%
Thrombopenie 68%
Transaminasenerhöhung 86%
Kompikationen der HME können in Form von Meningitiden, Lungenentzündungen (bis hin zum akuten Lungenversagen, Paparone 1995) und anderen Organbeteiligungen wie etwa Herzmuskelentzündungen ablaufen. Auch die HME ist unbehandelt nicht selten tödlich (Paddock 1997).
Bei Hunden wurde auch eine Ehrlichie (E. platys) gefunden, die sich in Thrombozyten vermehrt. Bei Stichproben fand man in einzelnen Hundepopulationen in Taiwan zwischen 8 und 90% Infizierte ( Chang 1996). Diese Art kommt wie E. canis in zahlreichen Ländern vor und kann für schwer verlaufende Ko-Infektionen mit diesem Erreger verantwortlich sein (Harrus 1997).
Im Prinzip können sowohl HGE als auch HME durch Färbung von peripheren Blutausstrichen erkannt werden. Die Erreger stellen sich in den spezifischen Wirtszellen als "Morula" (lat. für Maulbeere) dar. Die Sensitivität dieses Nachweisverfahrens ist bei der HGE deutlich günstiger, bei der HME gelingt der Nachweis nur im Ausnahmefall. Bei der üblichen maschinellen Auswertung der Differentialblutbilder besteht naturgemäß keine Chance, den Erreger zu erkennen.
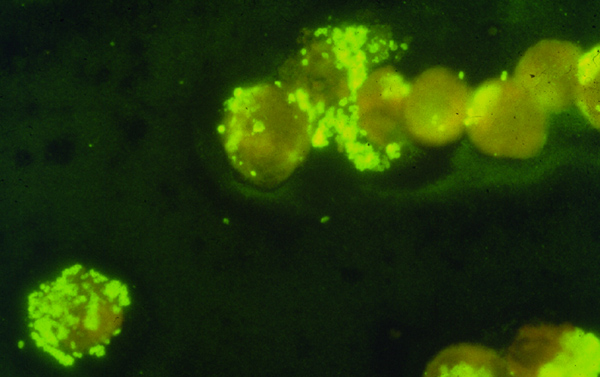
Die serologische Kreuzreaktivität zwischen einigen Ehrlichienarten ist groß. Dies macht man sich im klinischen Alltag zunutze, indem man zur Diagnose von E. chaffeensis die verwandte, aber besser kultivierbare Art E. canis verwendet. Zur serologischen Diagnostik der HGE (die von einer nah mit E. equi und E. phagozytophila verwandten, noch unbenannten Art verursacht wird), wird meist E. equi verwendet. Der Nachteil dieser Methode besteht darin, daß zwischen möglicherweise unterschiedlich pathogenen, aber kreuzreagierenden Arten nicht unterschieden werden kann. Da weltweit bei Borreliose-Infizierten zwischen 6 und 14% serologische Hinweise auf eine gleichzeitige Ehrlichiose-Infektion gefunden werden, stellt sich zumindest die Frage, ob weniger pathogene Ehrlichien hierfür verantwortlich sein könnten. Dies würde erklären, daß bayrische Waldarbeiter zu 14% seropositiv waren, ohne daß man Hinweise auf ein schweres Krankheitsbild der Betroffenen gefunden hat (Fingerle 1998).
Auch die PCR stellt ein zur Diagnose der Ehrlichiosen geeignetes Verfahren dar, geeignete Primer für die verschiedenen Arten lassen eine speziesspezifische Diagnose zu, was angesichts der bereits diskutierten Unsicherheiten der Serologie vielleicht einige offene Fragen zu beantworten hilft.
Da Ehrlichien obligat intrazellulär leben, sind nur wenige Antibiotikagruppen in der Lage, den Keim zu treffen. Standard in der Therapie der Ehrlichiosen ist Doxycyclin. Im Allgemeinen werden 2x100 mg über 14-20 Tage empfohlen. Neuere Makrolide und Fluorochinolone sind ebenfalls wirksam (Klein 1997). Grundsätzlich nicht wirksam sind Penicilline und Cephalosporine. Systematische Untersuchungen zur vergleichenden Therapie mit den verschiedenen theoretisch in Frage kommenden Antibiotika existieren bisher nicht.
Anderson BE et al.: Ehrlichia chaffeensis, a new species associated with human ehrlichiosis. J Clin Microbiol 12, 1991, 2741-45
Anderson BE et al.: Ehrlichia ewingii sp.nov., the etiologic agent of canine granulozytic ehrlichiosis. Int J Syst Bacteriol 1992, Apr, 299-302
Bakken JS et al.: Exposure to deer blood may be a cause of human granulozytic ehrlichiosis. Clin Infect Dis 23 (1996) 198
Barlough JE et al.: Detection of Ehrlichia risticii, the agent of Potomac horse fever, in freshwater stream snails (Pleuroceridae, Juga spp.) from northern California. Appl Envir Microbiol 64 (1998) 2888-2893
Bennington E, I Pratt: The life history of the salmon poisoning fluke, Nanophyetus salmincola CHAPIN. J Parasitol 46 (1960) 91-100
Carter N et al.: Fourth nerve palsy caused by Ehrlichia chaffeensis Neuroophthalmol 17 (1997) 47-50
Chen SM et al.: Identification of a granulozytic Ehrlichia species as the etiologic agent of human disease. J Clin Microbiol 32 (1994) 589-595
Chang AC et al.: Canine infectious cyclic thrombocytopenia found in Taiwan. J Vet Med Sci 58 (1996) 473-476
Davidson DE et al.: Prophylactic and therapeutic use of tetracycline during an epizootic of ehrlichiosis among military dogs. J Am Vet Med Assoc 15 (1978) 697-700
Dunn BE et al.: Identification of Ehrlichia chaffeensis morulae in cerebrospinal fluid mononuclear cells. J Clin Microbiol 1992, Aug, 2207-10
Fingerle V et al.: Human granulocytic ehrlichiosis in southern Germany: increased seroprevalence in high risk groups. J Clin Microbiol 35, (1997) 3244-3247
Fishbein DB et al.: Human ehrlichiosis in the United States 1985 to 1990. Ann Intern Med 120 (1994) 736-743
Foreyt WJ et al.: Salmon poisoning disease in juvenile coyotes: clinical evaluation and infectivity of metacercariae and Rickettsiae. J Wildl Dis 23 (1987) 412-417
Gribble DH: Equine Ehrlichiosis. J Am Vet Med Assoc 15 (1969) 462-469
Jackson RT & Jackson JW. Ehrlichiosis with systemic sepsis syndrome. Tenn Med 90 (1997) 185-186
Jacobs RF et al.: Ehrlichiosis in children. J Pediatr 8, 1997, 184-192
Harrus S et al.: Clinical manifestations of infectious canine cyclic thrombopenia. Vet Rec 141 (1997) 247-250
Kadatzke JT et al.: Cluster of tick borne infections at Fort Chaffee, Arkansas: Rickettsiae and Borrelia burgdorferi in ixodic ticks. J Med Entomol 1992, July
Klein MB et al.: Antibiotic susceptibility of the newly cultivated agent of human granulocytic ehrlichiosis. Promising activity of quinolones and rifamycins. Antimicr Agents Chemother 41(1997) 76-79
Klein MB et al.: Primary bone marrow progenitors of both granulozytic and monozytic lineages are susceptible to infection with the agent of human granulozytic ehrlichiosis. J Infect Dis 1997, Nov, 1405-09
Lockhart JM et al.: Isolation of Ehrlichia chaffeensis from wild white-tailed deer (Odocileus virginianus) confirms their role as natural reservoir hosts. J Clin Microbiol 7, 1997
Madigan JE et al.: Serologic evidence of Potomac horse fever in three California horses with enterocolitis and fever. J Equine Vet Sci 41 (1987) 8-10
Ratnasamy N et al.: Central nervous system manifestations of human ehrlichiosis. Clin Infect Dis 8 (1996) 314-319
Paddock CD et al.: Isolation and characterzation of Ehrlichia chaffeensis strains from patients with fatal ehrlichiosis. J Clin Microbiol 35 (1997) 2496-2502
Palmer JE: Potomac horse fever. Vet Clin North Am Equine Pract 9 (1993) 399-410
Paparone PW et al.: Ehrlichiosis with panzytopenia and ARDS. N J Med 92 (1995) 381-85
Petersen LR et al.: An outbreak of ehrlichiosis in members of an Army Reserve unit exposed to ticks. J Infect Dis 159 (1989) 562-568
Petrovec M et al.: Human disease in Europe caused by an granulozytic Ehrlichia species. J Clin Microbiol 35 (1997) 1556-1559
Pusterla N et al.: Granulocytic ehrlichiosis in two dogs in switzerland. J Clin Microbiol 9, 1997
Pusterla N et al.: Serological, hematologic, and PCR-studies of cattle in an area of Switzerland in which tick-borne fever (caused by Ehrlichia phagozytophila) is endemic. Clin Diagn Lab Immunol 5 (1998) 325-327
Rikihisa Y, BD Perry: Causative ehrlichial organisms in Potomac horse fever. Infect Immun 49 (1985) 513-517
Shea KW et al.: Rhabdomyolysis associated with Ehrlichia chaffeensis infection. Clin Infect Dis 22 (1995) 605
Walker DH: Emerging Human Ehrlichioses: Recently recognized, widely distributed, life-threatening Tick-borne diseases. In Scheld WM et al. (Eds.) Emerging Infections I, ASM Press, Washington DC, 1997
Wong S et al.: Ehrlichial infection as a cause of severe respiratory distress syndrome. N Engl J Med 1, 1996